Responsables :
Sylvie Fournel-Gigleux
Mohammed Ouzzine
Guillermo Barreto
Les GAG sont les molécules les plus abondantes sur terre et des composants fondamentaux des cellules et tissus des organismes vivants. Leur rôle primordial dans une multitude de mécanismes biologiques, ainsi que leur potentiel thérapeutique et diagnostique, ont longtemps été sous-estimés. Ces biomolécules complexes sont des polymères oligosaccharidiques linéaires sulfatés, liés à des protéines sous forme de protéoglycanes (PG). Les PG sont stratégiquement associés aux membranes plasmiques, abondants dans les matrices extracellulaires (MEC) et récemment observés dans le noyau cellulaire. Leur importante capacité d’interaction avec des effecteurs cellulaires (comme les facteurs de croissance et les cytokines) font des PG et des GAG des régulateurs physiopathologiques fondamentaux des processus cellulaires et tissulaires.
Les recherches de l’équipe GlycoBio s’appuient sur des approches multi-échelles, de la molécule au patient pour disposer de connaissances fondamentales en glycobiologie afin de proposer des outils thérapeutiques et diagnostiques dans des pathologies impliquant des perturbations de la biosynthèse des GAG et/ou des collagènes. L’équipe explore la machinerie de biosynthèse et les mécanismes physiopathologiques d’assemblage des GAG et des collagènes, principales macromolécules du micro- et macro-environnement cellulaire. Nous étudions la structure, les fonctions et les régulations des enzymes responsables de la biosynthèse et de la maturation des GAG (glycosyltransférases, sulfotransférases) et du collagène (lysyl oxidase, prolyl hydroxylases), mais également les fonctions moléculaires atypiques des GAGs, notamment dans l’organisation nucléaire.
Mots-clés: Protéoglycanes (PG), glycosaminoglycanes (GAG), matrice extracellulaire (MEC), glycosyltransférases, épigénétique, approches multi-omiques, cancer, fibrose, maladies génétiques rares.
UPLC-MS
muti-omics
nano-HPLC
Mass spectrometry
modelisation moléculaire
FPLC
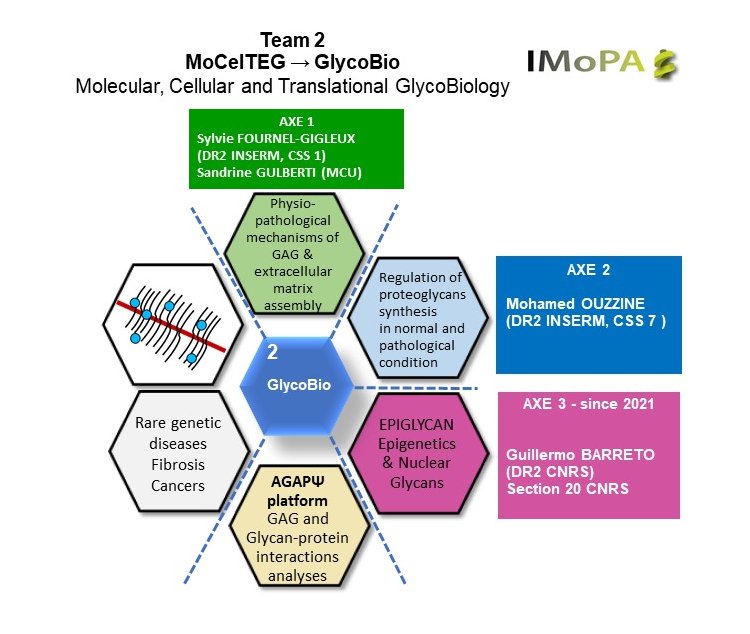
L’objectif de l’axe 1 est de comprendre les mécanismes d’assemblage des GAG et des collagènes ainsi que leurs interactions dans la matrice extracellulaire en situation physiopathologique. Nous ciblons principalement les maladies génétiques rares dues à des variants pathogènes des enzymes d’initiation de la biosynthèse des GAG (aussi appelées linkeropathies) impliqués dans certains syndromes d’Ehlers-Danlos (SED). Nous étudions également d’autres maladies génétiques rares du métabolisme des GAG comme les mucopolysaccharidoses (MPS) et des pathologies plus fréquentes telles que la fibrose et les cancers dans lesquelles les GAG et les collagènes jouent un rôle important. A terme, les connaissances de ces systèmes de biosynthèse et de leur régulation permettront de développer des thérapeutiques corrigeant les métabolismes affectés en situation pathologique.
Nous explorons l’hypothèse selon laquelle les glycosyltransférases et leurs potentiels partenaires (comme les kinases ou les sulfotransférases) sont associés en complexes multiprotéiques dans l’appareil de Golgi, assurant et régulant la formation de l’amorce des chaines de GAG. Pour le démontrer, nous faisons appel à des techniques d’immunoprécipitation, de fluorescence, des approches biophysiques et structurales (collaboration avec l’IBS à Grenoble) et bio-informatiques (collaboration avec le LORIA à Nancy). Nous étudions in silico et expérimentalement les conséquences des variants pathogènes d’une glycosyltransférase impliquée dans la biosynthèse l’amorce, la β3GalT6, sur sa structure et sa fonction et la potentielle influence délétère des mutations sur la formation des complexes multiprotéiques (projet financé par l’ANR 2023, Glycolink).
Nous explorons plusieurs pistes diagnostiques des SED basées sur des approches transcriptomiques et protéomiques pour aboutir à un diagnostic fiable de la maladie, complétant ainsi l’identification de la mutation des gènes codant les enzymes cible de ces linkeropathies (collaboration avec le Centre de Génétique Moléculaire de Gent en Belgique). Des approches biochimiques complémentaires et de spectrométrie de masse fourniront des données supplémentaires sur la maturation et l’assemblage des GAG et des collagènes. La correction des variants pathogènes par ingénierie moléculaire est une piste que nous explorons en parallèle à l’aide de modèles cellulaires invalidés pour les gènes cible.
Nous avons également initié le développement d’inhibiteurs de la biosynthèse des GAG en ciblant une enzyme précoce de la voie de biosynthèse, la β4GalT7 dans le contexte du traitement des mucopolysaccharidoses (MPS). Ce projet s’appuie sur l’identification dans notre équipe de candidats issus d’un criblage haut débit capables d’inhiber l’activité de la β4GalT7 in vitro (collaboration avec la PCBIS à Strasbourg). Le projet inclut la validation de candidats médicaments in vitro et in cellulo ainsi que des approches in silico utilisant des modèles bio-informatiques tridimensionnels dynamiques. D’autres enzymes ou cofacteurs/partenaires pourront en parallèle être considérés comme cibles d’inhibiteurs (projet financé par la Fondation Maladies Rares).
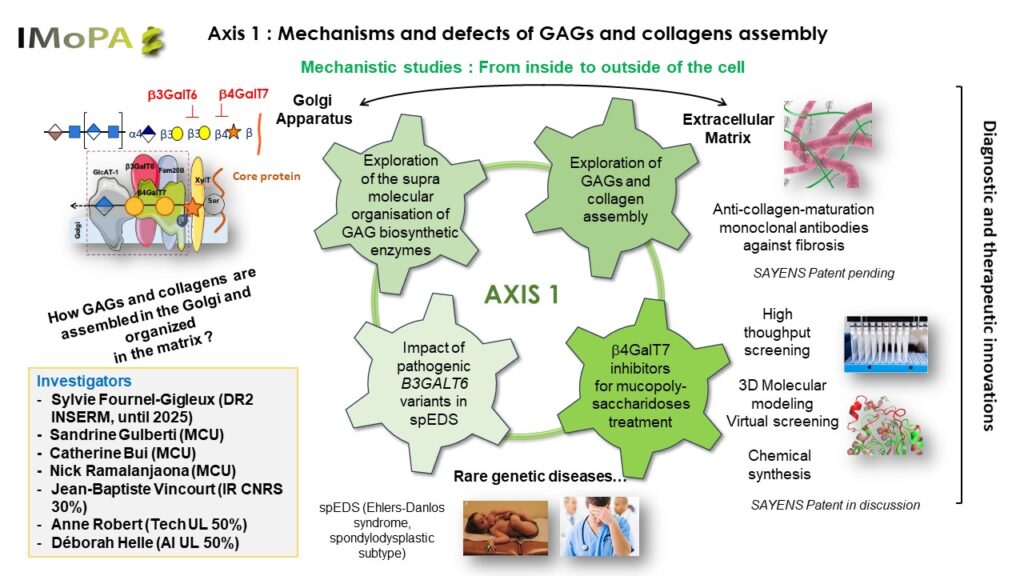


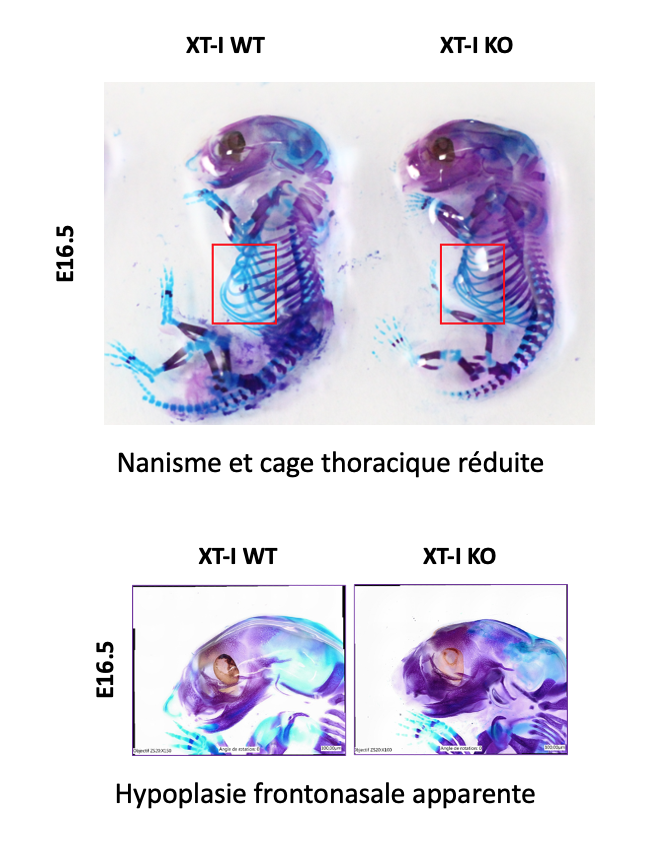
Les travaux de l’axe 2 portent sur l’étude du rôle physiopathologique, de la régulation dans les conditions normales et pathoilogiques des protéoglycanes (PGs). Nous avons développé des souris knock-out pour le gène de la XT-I, GT responsable de l’initiation de la synthèse des chaînes de GAG des PGs. Nous avons montré que la déficience en XT-I chez la souris induit un nanisme sévère dû à l’accélération de l’hypertrophie chondrocytaire et de l’ossification endochondrale associée à une perte de l’organisation des chondrocytes et des fibres de collagène dans la plaque de croissance. Ces anomalies pourraient être à l’origine du nanisme produit par la déficience en XT-I chez les patients atteints du syndrome Desbuquois. Nous souhaitons par la suite identifier les mécanistiques responsables de la perte de synthèse des chaînes longues de GAG des PG induit par l’invalidation de la XT-I. Identifier les mécanismes responsables des anomalies osseuses observées chez les patients déficients en XT-I en utilisant des souris knockout pour le gène au niveau des progéniteurs d’ostéoblastes.
Les travaux portent également sur TMEM165, une protéine du Golgi identifiée chez des patients atteint du syndrome CDG et dont la fonction serait le maintien de l’homéostasie en ion Ca2+/Mn2+.Nous avons montré pour la première fois que la déficience en TMEM165 inhibe la polymérisation des chaînes de GAG des PG en utilisant les fibroblastes de patients CDG et des cellules invalidées pour TMEM165. Nous avons généré des souris invalidées pour le gène TMEM165 au niveau du cartilage et de l’os, respectivement. Ces souris présentent un nanisme important et des anomalies osseuses mimant la pathologie humaine. Nos objectifs sont : 1) Déterminer l’impact de la délétion de TMEM165 sur la synthèse des PG dans la plaque de croissance et dans les tissus osseux. 2) Explorer les anomalies du développement ostéoarticulaire et déterminer les mécanismes moléculaires impliqués. 3) Evaluer l’effet de la supplémentation en Mn2+ sur le phénotype des souris invalidées pour le gène de TMEM165. Ce projet est financé par l’ANR ENIGMncA obtenu en 2022.

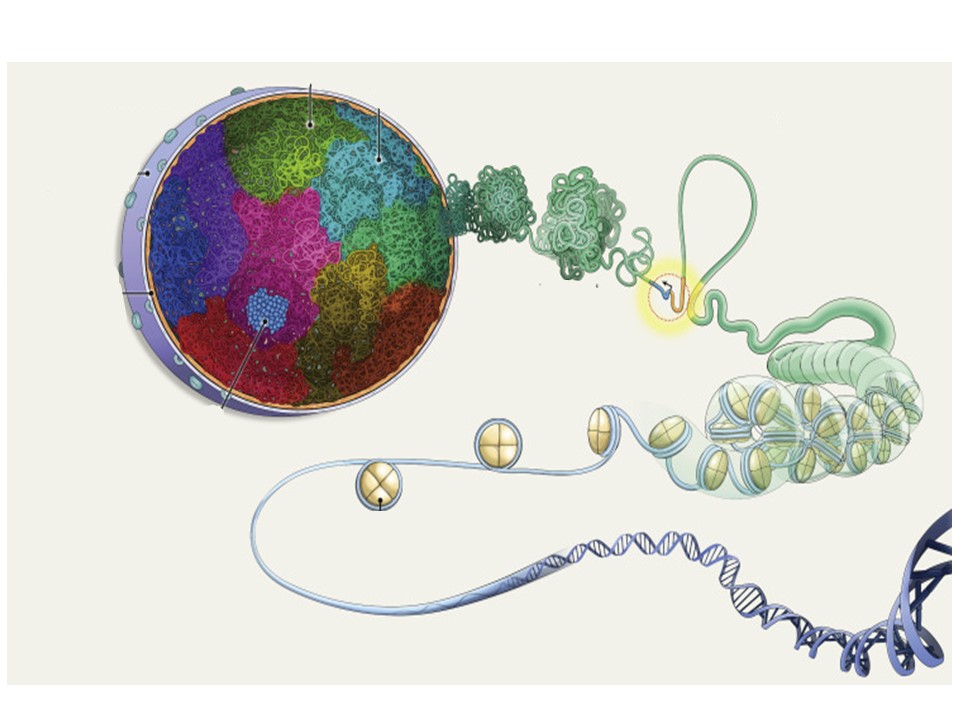
Les activités scientifiques du groupe de recherche EPIGLYCAN sont centrées sur les mécanismes épigénétiques régulant la transcription et l’organisation tridimensionnelle (3D) du génome dans des conditions physiologiques et leurs altérations dans des pathologies chroniques, telles que le cancer du poumon et la fibrose pulmonaire.
Nous possédons une vaste expertise scientifique dans la régulation de la transcription médiée par la chromatine et dans l’organisation du génome 3D médiée par des complexes macromoléculaires ARN-protéine contenant des protéines non histones associées à la chromatine, des ARN nucléaires non codants (ARNnc) et des structures secondaires d’ADN. Dans ce contexte nous étudions également le rôle des glycanes nucléaires.
Nous utilisons dans nos projets la spectrométrie de masse à haute résolution et les technologies de séquençage de nouvelle génération (NGS) pour surveiller divers aspects pertinents pour la régulation de la transcription médiée par la chromatine et l’organisation du génome 3D, tels que les protéines nucléaires, les glycanes nucléaires, les modifications d’histone, le dépôt d’histone, Méthylation de l’ADN, ARNnc régulateurs, structures secondaires d’acides nucléiques, territoires chromosomiques, domaines d’association topologique (TAD) auto-interactifs, entre autres.
L’analyse intégrative de ces études multi-omiques donne un aperçu des processus se produisant dans le noyau des cellules dans des conditions physiologiques et de leurs altérations dans des pathologies chroniques. Les mécanismes identifiés dans ces études multi-omiques sont ensuite confirmés par des expériences fonctionnelles basées sur des modèles pathologiques in vivo chez la souris et sur des tissus humains.




| IE, ULProjets : Biographie Bureau : BiopôleContacts |
| DR, CNRSMon groupe de recherche étudie les mécanismes épigénétiques régulant la transcription et l’organisation du génome 3D dans des conditions physiologiques et leurs altérations dans les pathologies chroniques. J’ai publié plus de 55 articles dans des revues scientifiques reconnues. Je suis l’inventeur principal de 2 brevets actuellement sous licence, avec des applications cliniques. Je codirige une étude clinique. Dans mon groupe, j’ai encadré 23 scientifiques (5 post-doctorants, 11 doctorats, 7 masters) qui poursuivent des carrières prometteuses. Guillermo Barreto CV – Pub Med – Google Scholar – ORCID Liste de 10 publications sélectionnées: [10] Corderro J, Swaminathan G, Rogel-Ayala DG, Rubio K, Elsherbiny A, Günther S, Braun T, Dobreva G, and Barreto G. 3D genome organization during TGFB-induced transcription requires nuclear microRNA and G-quadruplexes. BioRxiv; 2023. doi:10.1101/2023.12.22.573061 – Manuscript under revision after peer review at Nat Commun (IF 17.694) [9] Rubio K, Romero-Olmedo AJ, Pouya S, Swaminathan G, Ranvir VP, Rogel-Ayala DG, Cordero J, Günther S, Metha A, Bassaly B, Braubach P, Wygrecka M, Gattenlöhner S, Tresch A, Braun T, Dobreva G, Rivera MN, Singh I, Graumann J and Barreto G. Non-canonical integrin signaling activates EGFR and RAS-MAPK-ERK signaling in small cell lung cancer. Theranostics; 2023; 13(8):2319-2342. doi:10.7150/thno.79493 (IF 12.400) [8] Dobersch S, Rubio K, Singh I, Günther S, Graumann J, Cordero J, Castillo-Negrete R, Huynh MB, Mehta A, Braubach P, Cabrera-Fuentes H, Bernhagen J, Chao CM, Bellusci S, Günther A, Preissner KT, Dobreva G, Wygrecka M, Braun T, Papy-Garcia D and Barreto G. Positioning of nucleosomes containing γ-H2AX precedes active DNA demethylation and transcription initiation. Nat Commun; 2021; Feb 16;12(1):1072. doi: 10.1038/s41467-021-21227-y (IF 17.694) [7] Rubio K, Singh I, Dobersch S, Sarvari P, Günther S, Cordero J, Mehta A, Wujak L, Cabreras-Fuentes H, Chao CH, Bellusci S, Günther A, Dobreva G, Wygrecka M, Seeger W, Preissner KT, Savai R, Papy-Garcia D, Heikenwalder M, Pullamsetti SS, Braun T and Barreto G. Inactivation of nuclear histone deacetylases by EP300 disrupts the MiCEE complex in Idiopathic Pulmonary Fibrosis. Nat Commun; 2019; May 20;10(1):2229. doi: 10.1038/s41467-019-10066-7 (IF 17.694) [6] Gao R, Liang X, Cheedipudi S, Cordero J, Jiang X, Zhang Q, Caputo L, Günther S, Kuenne C, Ren Y, Bhattacharya S, Yuan X, Barreto G, Chen Y, Braun T, Evans SM, Sun Y and Dobreva G. Pioneering function of Isl1 in epigenetic control of cardiomyocyte cell fate. Cell Research; 2019; Apr 25. doi: 10.1038/s41422-019-0168-1 (IF 46.297) [5] Jia Y, Vong JS, Asafova AS, Garvalov BK, Caputo L, Cordero J, Boettger T, Günther S, Fink L, Acker T, Barreto G, Seeger W, Braun T, Savai R and Dobreva G. Lamin B1 loss drives lung cancer development and metastasis by epigenetic derepression of RET proto-oncogene. J Exp Med; 2019; Apr 23. pii: jem.20181394. doi: 10.1084/jem.20181394 (IF 17.579) [4] Dobersch S, Rubio K and Barreto G. Pioneer factors and architectural proteins mediating embryonic expression signatures in cancer. Trends Mol Med; 2019; Feb 19. pii: S1471-4914(19)30019-X. doi: 10.1016/j.molmed.2019.01.008 (IF 15.272) [3] Singh I, Contreras A, Cordero J, Rubio K, Dobersch S, Günther S, Jeratsch S, Mehta A, Krüger M, Graumann J, Seeger W, Dobreva G, Braun T and Barreto G. MiCEE is a ncRNA-protein complex that mediates epigenetic silencing and nucleolus organization. Nat Genet; 2018; Jul; 50(7):990-1001. doi: 10.1038/s41588-018-0139-3. Epub 2018 Jun 4. (IF 41.379) [2] Mehta A, Cordero J, Dobersch S, Romero-Olmedo AJ, Savai R, Bodner J, Chao CM, Fink L, Guzmán-Díaz E, Singh I, Dobreva G, Rapp UR, Günther S, Ilinskaya ON, Bellusci S, Dammann RH, Braun T, Seeger W, Gattenlöhner S, Tresch A, Günther A and Barreto G. Non-invasive lung cancer diagnosis by detection of GATA6 and NKX2-1 isoforms in exhaled breath condensate. EMBO Mol Med; 2016; 8, 1380-1389, doi:10.15252/emmm.201606382 (IF 14.000) [1] Singh I, Ozturk N, Mehta A, Cordero J, Hasan D, Cosentino C, Sebastian C, Krüger M, Looso M, Carraro G, Bellusci S, Seeger W, Braun T, Mostoslavsky R and Barreto G. High Mobility Group protein mediated transcription requires DNA damage marker γ-H2AX. Cell Research; 2015 Jul;25(7):837-50; doi: 10.1038/cr.2015.67 (IF 46.297) Bureau : BiopôleContacts |
| Maître de Conférence, Université de Lorraine Biographie : Depuis 2017, maître de conférences à Université de Lorraine 2016-2017 : Chercheur postdoctorant à Université de Lorraine 2015-2016 : Chef de projets à GenOway, Lyon 2013-2014 : Chercheur postdoctorant à Institut Imagine, Paris 2010-2012 : Chercheur postdoctorant à Newcastle University (Royaume Uni) 2010 : Doctorat à Université Henri Poincaré, Nancy Recherche : études fonctionnelles et structurales de la β1,3-galactosyltransferase 6 (β3GalT6), transcriptome de fibroblastes de patients déficients en β3GalT6, étude et analyse des protéoglycanes, modèle cellulaire de synthèse matricielle et études biomécaniques
Mots-clés : protéoglycanes, glycosyltransférases, maladies rares des tissus conjonctifs, glycobiologie |
Ph | DR, INSERMResearch and Teaching My research career is devoted to exploring the structure-function and regulation of glycosyltransferases involved in key biological processes. Since 2000, my team investigates the enzyme machinery responsible for glycosaminoglycan (GAG) synthesis and its pathological disorders in connective tissue disorders and cancer. Our current interest is on the patho-mechanisms of GAG metabolism-related defects and the search for therapeutic and engineering strategies. I have published 121 original articles and reviews (WoS h38 5,047 citations), one patent, edited 2 books and written 4 book chapters. I have trained 15 PhD and > 20 Master students, 9 post-doctoral researchers and 3 technical staff. Since 2000, I have coordinated or co-coordinated > 40 grants. Key-words: structural glycobiology, molecular engineering, biochemistry, physiopathology, glycosyltransferases, glycosaminoglycans, rare genetic diseases, cancer. Biography 1986 – PhD Thesis in Pharmaceutical Sciences, Fce 1987 – 1988 Welcome Trust Post-Doctoral Fellowship, Dundee, UK 1995 –1996 MRC Senior Scientist Fellowship, Dundee, UK 1989 – 2000 Chargée de Recherches INSERM 2009 – 2012 Contrat d’interface INSERM-University of Dundee, UK Since 2000 – Director of Research INSERM Awards 2007 – 2013 Awarded Honorary Professor of the University of Dundee, UK Responsibilities Since 2013 – Co-Head of MolCelTEG Team (Team 2 IMoPA) Since 2013 – Member of Alliance Nationale pour les Sciences de la Vie et de la Santé ITMO BMSV Since 2015 – Member of International Ehlers-Danlos Syndrome Consortium 2010 – 2017 Director of the International Associated Laboratory (IAL SFGEN) CNRS-UL-University of Dundee 2012 – 2017 Member of Scientific Committee “Ecole Doctorale” BioSE 2017 – 2021 Member of CNRS Committee (Comité National CNRS, CoNRS Section 20) Bureau : Biopôle, 2ème étage, 2G38 |
| MCU, ULProjets : Biographie Bureau : BiopôleContacts |
| IE, ULProjets : Biographie Bureau : BiopôleContacts |
Photo | DR, INSERMProjets : Biographie Bureau : BiopôleContacts |
Photo | MCY, ULProjets : Biographie Bureau : BiopôleContacts |
TE, ULProjets : Biographie Bureau : BiopôleContacts |
 | DoctoranteJe suis doctorant actuellement en troisième année de doctorat. J’ai le privilège d’être encadré par le Dr Guillermo Barreto, chef de groupe du laboratoire EPIGLYCAN, et par le Pr Thomas Braun, directeur de l’Institut Max Planck de recherche sur le cœur et les poumons. Sous leur direction, nos recherches visent à caractériser les mécanismes épigénétiques complexes qui sous-tendent le développement des maladies pulmonaires. Diana G. Rogel Ayala CV – Pub Med – Google Scholar – ORCID Liste des publications: [7] Swaminathan G, Rogel-Ayala DG, Armich A and Barreto G. Implications in Cancer of Nuclear Micro RNAs, Long Non-Coding RNAs, and Circular RNAs Bound by PRC2 and FUS. Cancers; 2024, 16(5), 868; https://doi.org/10.3390/cancers16050868 [6] Cordero J, Swaminathan G, Rogel-Ayala DG, Rubio K, Elsherbiny A, Günther S, Braun T, Dobreva G, and Barreto G. 3D genome organization during TGFB-induced transcription requires nuclear microRNA and G-quadruplexes. BioRxiv; 2023. doi:10.1101/2023.12.22.573061 – Manuscript under revision after peer review at Nature Communications [5] Rubio K, Romero-Olmedo AJ, Pouya S, Swaminathan G, Ranvir VP, Rogel-Ayala DG, Cordero J, Günther S, Metha A, Bassaly B, Braubach P, Wygrecka M, Gattenlöhner S, Tresch A, Braun T, Dobreva G, Rivera MN, Singh I, Graumann J and Barreto G. Non-canonical integrin signaling activates EGFR and RAS-MAPK-ERK signaling in small cell lung cancer. Theranostics; 2023; 13(8):2319-2342. doi:10.7150/thno.79493 [4] Rogel-Ayala DG, Muñoz-Medina JE, Vicente-Juárez VD, Grether-González P, Morales-Barquet DA, Martínez-García AJ, Echaniz-Avliles MOL, Sevilla-Montoya R, Martínez-Juárez A, Arteaga-Vázquez J, Ángeles-Martínez J, Vargas-Alarcón G, Hidalgo-Bravo A and Monroy-Muñoz IE. Association of the EPAS1 rs7557402 polymorphism with hemodynamical significant PDA closure failure in premature newborns under Pharmacological treatment with ibuprofen. Diagnostics (Basel); 2023 Aug 1;13(15):2558. doi: 10.3390/diagnostics13152558. [3] Rubio K, Hernández-Cruz EY, Rogel-Ayala DG, Sarvari P, Isidoro C, Barreto G and Pedraza-Chaverri J. Nutriepigenomics in Environmental-Associated Oxidative Stress. Antioxidants (Basel). 2023 Mar 21;12(3):771. doi: 10.3390/antiox12030771. [2] Aguinaga-Ríos M, Valdespino-Vázquez MY, Medina-Castro D, Espino-Sosa S, Sevilla-Montolla R, Miranda-Araujo O, Acevedo-Gallegos S, Monroy-Muñoz IE, Helguera-Reppeto AC, Pérez-Durán J, Mariscal-Mendizabal LF, Franco-Murillo MR, Lara-Enríquez RM, Armijos-Torres JC, Rogel-Ayala DG, Cardona-Pérez JA. Causal analysis of fetal death in high-risk pregnancies. Journal of Perinatal Medicine; 2021; 49(6), 740-747. https://doi.org/10.1515/jpm-2020-0352 [1] Morales-Avila E, Ferro-Flores G, Ocampo-García BE, López-Téllez G, López-Ortega J, Rogel-Ayala DG, Sánchez-Padilla D. Antibacterial Efficacy of Gold and Silver Nanoparticles Functionalized with the Ubiquicidin (29–41) Antimicrobial Peptide. Journal of Nanomaterials; 2017; vol. 2017, Article ID 5831959. https://doi.org/10.1155/2017/5831959 Bureau : BiopôleContacts |
DocotorantJe suis doctorant en 3ème année. étudiant travaillant sous la supervision du Dr Guillermo Barreto. Mon projet se concentre sur l’étude de différents aspects de la structure de la chromatine, notamment le génome tridimensionnel, les ARN non codants, les modifications des histones et les structures d’ADN secondaires non canoniques telles que les boucles R et les G4 dans les cellules d’adénocarcinome du poumon. Ce projet fournira une base moléculaire pour la conception de nouvelles thérapies contre le cancer du poumon non à petites cellules (NSCLC). Guruprasadh Swaminathan CV – PubMed – Google Scholar – ORCID Liste des publications: [8] Swaminathan G, Rogel-Ayala DG, Armich A and Barreto G. Implications in Cancer of Nuclear Micro RNAs, Long Non-Coding RNAs, and Circular RNAs Bound by PRC2 and FUS. Cancers. 2024; 16(5):868. doi.org/10.3390/cancers16050868 (IF 5.2) [7] Cordero J, Swaminathan G, Rogel-Ayala DG, Rubio K, Elsherbiny A, Günther S, Braun T, Dobreva G, and Barreto G. 3D genome organization during TGFB-induced transcription requires nuclear microRNA and G-quadruplexes. BioRxiv; 2023. doi:10.1101/2023.12.22.573061 – Manuscript under revision after peer review at Nat Commun (IF 17.694) [6] Rubio K, Romero-Olmedo AJ, Pouya S, Swaminathan G, Ranvir VP, Rogel-Ayala DG, Cordero J, Günther S, Metha A, Bassaly B, Braubach P, Wygrecka M, Gattenlöhner S, Tresch A, Braun T, Dobreva G, Rivera MN, Singh I, Graumann J and Barreto G. Non-canonical integrin signaling activates EGFR and RAS-MAPK-ERK signaling in small cell lung cancer. Theranostics; 2023; 13(8):2319-2342. doi:10.7150/thno.79493 (IF 12.400) [5] Kourani K, Jain P, Kumar A, Jangid AK, Swaminathan G, Durgempudi VR, Jose J, Reddy R, Pooja D, Kulhari H, Kumar L. Inulin coated Mn3O4 nanocuboids coupled with RNA interference reverse intestinal tumorigenesis in Apc knockout murine colon cancer models. Nanomedicine: Nanotechnology, Biology and Medicine; 2022; Feb;40:102504. doi: 10.1016/j.nano.2021.102504. (IF 5.4) [4] Kumar A, Singam A, Swaminathan G, Killi N, Tangudu NK, Jose J, Gundloori Vn R, Dinesh Kumar L. Combinatorial therapy using RNAi and curcumin nano-architectures regresses tumors in breast and colon cancer models. Nanoscale. 2022 Jan 6;14(2):492-505. doi: 10.1039/d1nr04411g. (IF 8.307) [3] Swaminathan G, Shigna A, Kumar A, Byroju VV, Durgempudi VR, Dinesh Kumar L. RNA interference and Nanotechnology: A promising alliance for next generation cancer therapeutics. Front. Nanotechnol. 2021 Jun 9;3:42. 3:694838. doi: 10.3389/fnano.2021.694838 [2] Swaminathan G, Byroju V.V Kumar, A Kourani K, Dinesh Kumar L. (2021). Acute Lymphoblastic Leukemia: Promising Technologies for the Management of the Disease. In L.T. Duncan (Ed.). Advances in Health and Disease. Volume 37 (pp. 1-70). Nova Science Publishers (https://novapublishers.com/shop/advances-in-health-and-disease-volume-37/) -Book chapter [1] Rawoof A, Swaminathan G, Tiwari S, Nair RA, Dinesh Kumar L. LeukmiR: a database for miRNAs and their targets in acute lymphoblastic leukemia. Database (Oxford). 2020 Jan 1;2020:baz151. doi: 10.1093/database/baz151. (IF 5.8) Bureau : BiopôleContacts |
| Ingénieur de Recherche, HDRManager Plateforme protéomique IBSLor, UAR 2008/US40 UL CNRS INSERM Recherche: Mécanismes moléculaires de l’assemblage des collagènes Nouvelles voies Thérapeutiques contre la dégénérescence fibrotique Approches: Fractionnement tissulaire et moléculaire; analyse quantitative relative sans marquage par spectrométrie de masse; caractérisation fonctionnelle des enzymes catalysant la maturation des collagènes par invalidation génétique dans des modèles cellulaires. Biographie: 2002: PhD de biologie cellulaire à l’Université Toulouse III. 2010: IR de plateforme CNRS. 2022: HDR de l’Université de Lorraine. Contacts |










Implications in Cancer of Nuclear Micro RNAs, Long Non-Coding RNAs, and Circular RNAs Bound by PRC2 and FUS. Swaminathan G, Rogel-Ayala DG, Armich A, Barreto G. Cancers (Basel). 2024 Feb 21;16(5):868. doi: 10.3390/cancers16050868. PMID: 38473229
Preliminary results from the EMoLung clinical study showing early lung cancer detection by the LC score. Rubio K, Müller JM, Mehta A, Watermann I, Olchers T, Koch I, Wessels S, Schneider MA, Araujo-Ramos T, Singh I, Kugler C, Stoleriu MG, Kriegsmann M, Eichhorn M, Muley T, Merkel OM, Braun T, Ammerpohl O, Reck M, Tresch A, Barreto G. Discov Oncol. 2023 Oct 3;14(1):181. doi: 10.1007/s12672-023-00799-9. PMID: 37787775
F-actin nanostructures rearrangements and regulation are essential for SARS-CoV-2 particle production in host pulmonary cells. Swain J, Merida P, Rubio K, Bracquemond D, Neyret A, Aguilar-Ordoñez I, Günther S, Barreto G, Muriaux D. iScience. 2023 Jul 17;26(8):107384. doi: 10.1016/j.isci.2023.107384. eCollection 2023 Aug 18. PMID: 37564698
Xylosyltransferase I mediates the synthesis of proteoglycans with long glycosaminoglycan chains and controls chondrocyte hypertrophy and collagen fibers organization of in the growth plate. Taieb M, Ghannoum D, Barré L, Ouzzine M. Cell Death Dis. 2023 Jun 9;14(6):355. doi: 10.1038/s41419-023-05875-0. PMID: 37296099
Non-canonical integrin signaling activates EGFR and RAS-MAPK-ERK signaling in small cell lung cancer. Rubio K, Romero-Olmedo AJ, Sarvari P, Swaminathan G, Ranvir VP, Rogel-Ayala DG, Cordero J, Günther S, Mehta A, Bassaly B, Braubach P, Wygrecka M, Gattenlöhner S, Tresch A, Braun T, Dobreva G, Rivera MN, Singh I, Graumann J, Barreto G. Theranostics. 2023 Apr 17;13(8):2384-2407. doi: 10.7150/thno.79493. eCollection 2023. PMID: 37215577
Nutriepigenomics in Environmental-Associated Oxidative Stress. Rubio K, Hernández-Cruz EY, Rogel-Ayala DG, Sarvari P, Isidoro C, Barreto G, Pedraza-Chaverri J. Antioxidants (Basel). 2023 Mar 21;12(3):771. doi: 10.3390/antiox12030771. PMID: 36979019.
Tissue-specific collagen hydroxylation at GEP/GDP triplets mediated by P4HA2. Wilhelm D, Wurtz A, Abouelfarah H, Sanchez G, Bui C, Vincourt JB. Matrix Biol. 2023 May;119:141-153. doi: 10.1016/j.matbio.2023.03.009. Epub 2023 Mar 30. PMID: 37003347
Editorial: Molecular basis of epigenetic regulation in cancer therapies. Carlos-Reyes A, Romero-Garcia S, López-Camarillo C, Barreto G, Prado-Garcia H. Front Genet. 2023 Jan 10;13:1115353. doi: 10.3389/fgene.2022.1115353. eCollection 2022. PMID: 36704341
Circulating hyaluronic acid signature in CAP and ARDS – the role of pneumolysin in hyaluronic acid shedding. Sauer A, Seeliger B, Jandl K, Erfinanda L, Wilhelm J, Alexopoulos I, Baal N, Birnhuber A, David S, Welte T, Barreto G, Gaertner U, Kwapiszewska G, Seeger W, Kuebler WM, Schaefer L, Wygrecka M; members of the CAPNETZ Study Group. Matrix Biol. 2022 Dec;114:67-83. doi: 10.1016/j.matbio.2022.11.003. Epub 2022 Nov 16. PMID: 36456058
Alterations in glycosaminoglycan biosynthesis associated with the Ehlers-Danlos syndromes. Syx D, Delbaere S, Bui C, De Clercq A, Larson G, Mizumoto S, Kosho T, Fournel-Gigleux S, Malfait F. Am J Physiol Cell Physiol. 2022 Dec 1;323(6):C1843-C1859. doi: 10.1152/ajpcell.00127.2022. Epub 2022 Aug 22. PMID: 35993517
ADAR1 Isoforms Regulate Let-7d Processing in Idiopathic Pulmonary Fibrosis. Díaz-Piña G, Rubio K, Ordoñez-Razo RM, Barreto G, Montes E, Becerril C, Salgado A, Cabrera-Fuentes H, Aquino-Galvez A, Carlos-Reyes A, Ruiz V. Int J Mol Sci. 2022 Aug 12;23(16):9028. doi: 10.3390/ijms23169028. PMID: 36012303.
Impact of the Exposome on the Epigenome in Inflammatory Bowel Disease Patients and Animal Models. Vieujean S, Caron B, Haghnejad V, Jouzeau JY, Netter P, Heba AC, Ndiaye NC, Moulin D, Barreto G, Danese S, Peyrin-Biroulet L. Int J Mol Sci. 2022 Jul 9;23(14):7611. doi: 10.3390/ijms23147611. PMID: 35886959. Review.
Characterization of an Innovative Biomaterial Derived From Human Wharton’s Jelly as a New Promising Coating for Tissue Engineering Applications. Fayon A, Helle D, Francius G, Vincourt JB, Regnault V, Dumas D, Menu P, El Omar R. Front Bioeng Biotechnol. 2022 Jun 13;10:884069. doi: 10.3389/fbioe.2022.884069. eCollection 2022. PMID: 35769101
Differential Effects of D-Galactose Supplementation on Golgi Glycosylation Defects in TMEM165 Deficiency. Durin Z, Houdou M, Morelle W, Barré L, Layotte A, Legrand D, Ouzzine M, Foulquier F. Front Cell Dev Biol. 2022 May 26;10:903953. doi: 10.3389/fcell.2022.903953. eCollection 20
Fgfr2b signaling is essential for the maintenance of the alveolar epithelial type 2 lineage during lung homeostasis in mice. Ahmadvand N, Lingampally A, Khosravi F, Vazquez-Armendariz AI, Rivetti S, Jones MR, Wilhelm J, Herold S, Barreto G, Koepke J, Samakovlis C, Carraro G, Zhang JS, Al Alam D, Bellusci S. Cell Mol Life Sci. 2022 May 19;79(6):302. doi: 10.1007/s00018-022-04327-w. PMID: 35587837
Epigenetic Regulation in Exposome-Induced Tumorigenesis: Emerging Roles of ncRNAs. Olmedo-Suárez MÁ, Ramírez-Díaz I, Pérez-González A, Molina-Herrera A, Coral-García MÁ, Lobato S, Sarvari P, Barreto G, Rubio K. Biomolecules. 2022 Mar 28;12(4):513. doi: 10.3390/biom12040513. PMID: 35454102
Lymphoid-specific helicase in epigenetics, DNA repair and cancer. Chen X, Li Y, Rubio K, Deng B, Li Y, Tang Q, Mao C, Liu S, Xiao D, Barreto G, Tao Y. Br J Cancer. 2022 Feb;126(2):165-173. doi: 10.1038/s41416-021-01543-2. Epub 2021 Sep 7. PMID: 34493821
© 2024 Ingénierie Moléculaire Cellulaire & Physiopathologie. Construit avec WordPress et le thème Mesmerize